
肺癌、食管癌、乳腺癌、皮肤癌、淋巴瘤等又有新适应证获批,快来看看有哪些药可用。
国内获批新药或新适应证
6月17日,帕博利珠单抗获批用于PD-L1表达阳性[CPS(综合阳性评分)≥10]的、既往一线治疗失败的局部晚期或转移性食管鳞状细胞癌(ESCC)。
6月19日,卡瑞利珠单抗获批联合化疗一线治疗晚期或转移性非鳞非小细胞肺癌(NSCLC)。
6月19日,卡瑞利珠单抗获批单药二线治疗晚期ESCC,适用人群对PD-L1表达无要求。
6月19日,伊尼妥单抗获批与化疗联合用于治疗HER2阳性的转移性乳腺癌。
美国获批新药或新适应证
6月15日,Lurbinectedin获批单药二线治疗广泛期小细胞肺癌(SCLC)。
6月16日,GemtuzumabOzogamicin获批用于治疗年龄≥1个月的新诊断患有CD33+急性髓系白血病(AML)的儿童患者。
6月16日,帕博利珠单抗获批用于单药后线治疗肿瘤突变负荷高(TMB-H,TMB≥10mut/Mb)的晚期实体瘤。
6月18日,Tazemetostat获批用于既往至少二线治疗失败的EZH2突变阳性的复发或难治性(R/R)滤泡性淋巴瘤(FL)和没有其他令人满意的治疗选择的R/RFL。
6月22日,Selinexor获批用于既往至少二线治疗失败的复发或难治性非特指型弥漫性大B细胞淋巴瘤(DLBCL)。
6月24日,帕博利珠单抗获批用于无法通过手术或放疗治愈的复发或转移性皮肤鳞癌(cSCC)。
国内获批新药或新适应证
1
帕博利珠单抗获批中国ESCC二线治疗,将中位OS延长近7个月
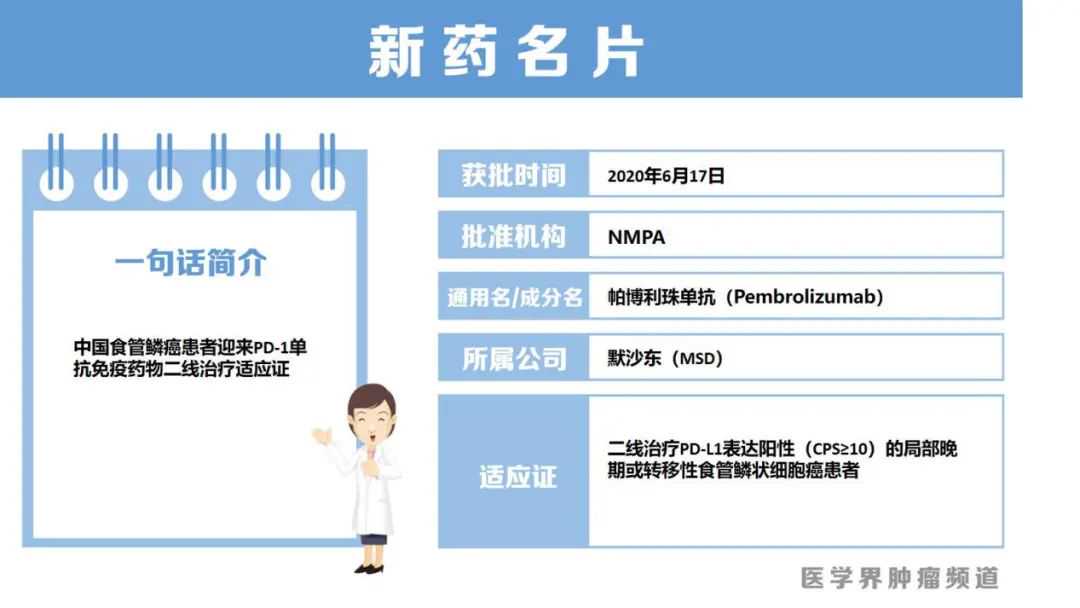
6月17日,中国国家药品监督管理局(NMPA)批准帕博利珠单抗用于二线治疗PD-L1表达CPS≥10的局部晚期或转移性ESCC患者。该适应证获批是基于KEYNOTE-181研究结果。
该III期研究纳入628例既往一线治疗进展的晚期或转移性腺癌或鳞状细胞癌食管癌,或胃食管连接部SiewertI型腺癌患者,随机接受帕博利珠单抗或化疗(多西他赛、紫杉醇或伊立替康)。结果显示,在PD-L1表达阳性(CPS评分≥10)人群中,相比化疗组,帕博利珠单抗组显著延长了中位总生存期(OS),为9.3个月(,P=0.0074)。
中国人群分析结果显示,在所有意向治疗人群(ITT)中,帕博利珠单抗组和化疗组的中位OS为8.4个月()。在中国ESCC患者中,两组的中位OS为8.4个月();在PD-L1CPS≥10患者中,帕博利珠单抗组的中位OS较化疗组延长了6.7个月,为12.0个月()。
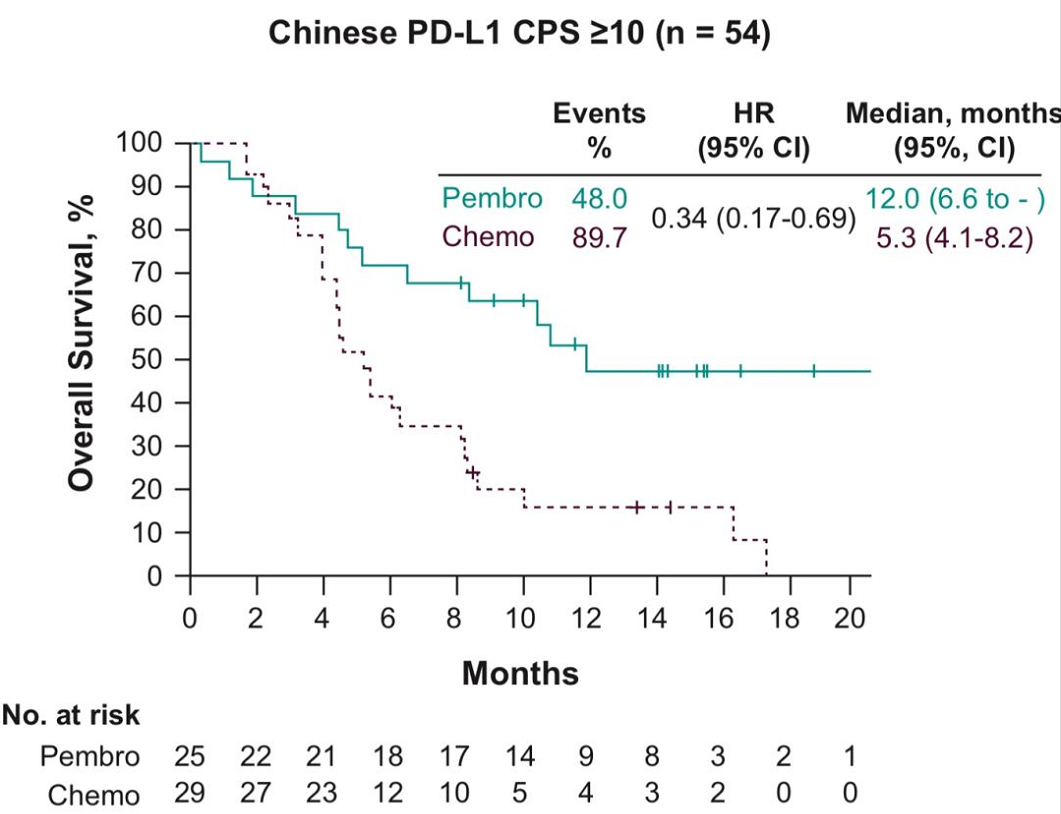
图1KEYNOTE-181研究的中国PD-L1阳性人群OS结果
2
NSCLC迎来首个国产PD-1单抗获批,卡瑞利珠单抗获得中国一线适应证

6月19日,卡瑞利珠单抗联合化疗获批用于一线治疗EGFR/ALK阴性晚期非鳞NSCLC患者。该适应证获批是基于CameLIII期研究结果。该研究纳入了中国未经治的非鳞NSCLC患者,随机接受卡瑞利珠单抗+化疗(培美曲塞+卡铂)或化疗治疗。
结果显示,相比单纯化疗,卡瑞利珠单抗+化疗组延长了总人群的中位无进展生存期(PFS),为11.3个月(,P=0.0002)。两组的客观缓解率(ORR)为60%(卡瑞利珠单抗+化疗)%(化疗)。在PD-L1表达阳性人群中,卡瑞利珠单抗的中位PFS达到15.2个月,而化疗组为9.9个月(,P=0.0023)。两组的中位OS未成熟,但卡瑞利珠单抗已经展现出获益的趋势。
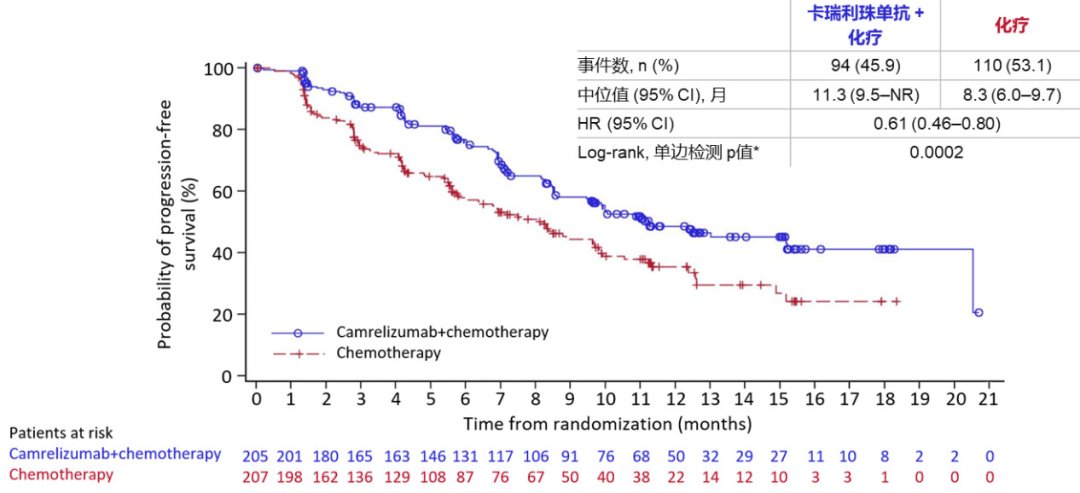
图2CameL研究的PFS结果
3
卡瑞利珠单抗获批中国ESCC适应证,获益不受患者PD-L1表达影响
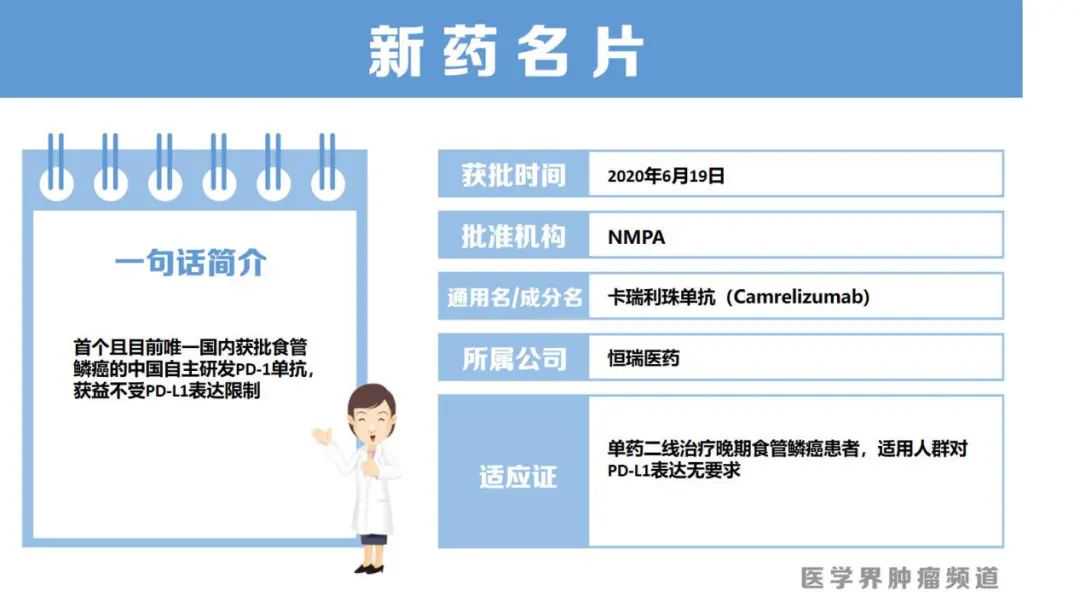
6月19日,除了NSCLC外,卡瑞利珠单抗还获批单药用于二线治疗晚期ESCC的适应证,且对患者的PD-L1表达无要求。该适应证获批是基于发表于《柳叶刀-肿瘤学》的ESCORTIII期研究结果。
该研究是一项仅针对中国晚期ESCC患者开展的随机对照研究,纳入了既往一线化疗进展的患者,随机分为卡瑞利珠单抗组或化疗组。
结果显示,相比化疗组,卡瑞利珠单抗组显著延长了中位OS,为8.3个月(,P=0.001)。同时,卡瑞利珠单抗组患者的ORR更高(20.2%%),中位缓解持续时间更长(DoR,7.4个月,)。这是首个且目前唯一一个中国自主研发的PD-1单抗获批用于ESCC,意义重大。
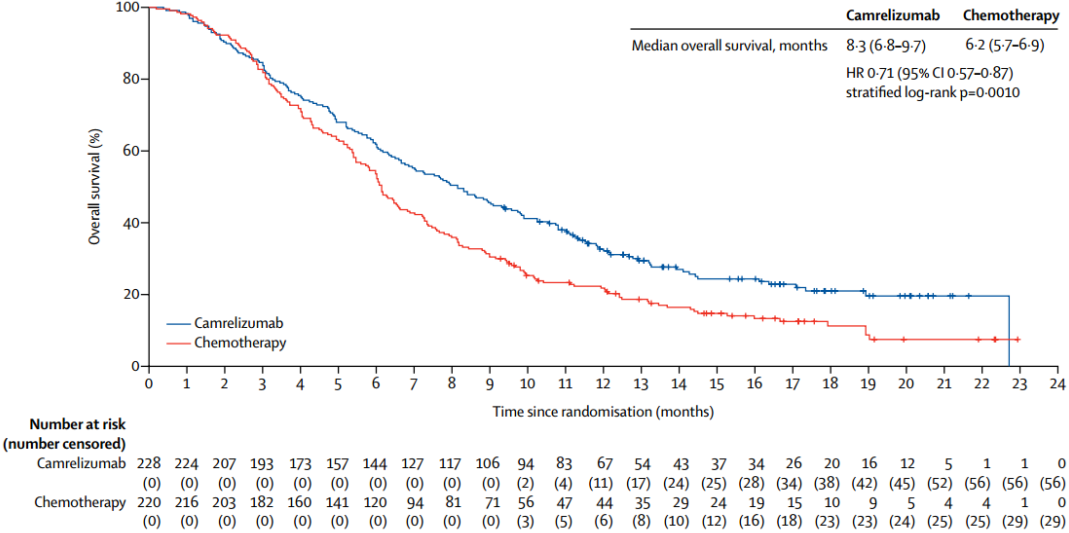
图3ESCORT研究的OS结果
4
中国自主研发的HER2单抗获批,国内乳腺癌患者迎来新选择
6月19日,伊尼妥单抗获批与化疗联合用于治疗HER2阳性的转移性乳腺癌。该药是中国自主研发的可结晶段(Fc段)修饰和生产工艺优化的抗HER2单抗,具有更强的抗体依赖的细胞介导的细胞毒性作用(ADCC)。
体外研究显示,伊尼妥单抗与曲妥珠单抗具有同样的HER2抗原结合活性及亲和力,对体外癌细胞增殖的抑制作用、蛋白空间折叠和热稳定性等几个关键属性上两者保持一致。而且,尼妥珠单抗的ADCC效益比曲妥珠单抗提高了约11.1%。中国创新药获批,有望为更多中国HER2阳性的乳腺癌患者带来获益。
美国获批新药或新适应证
5
SCLC迎新药,Lurbinectedin二线治疗ORR达35.2%

SCLC新药研发进展缓慢。所幸,6月15日,美国食品药品监督管理局(FDA)批准了Lurbinectedin(海鞘素衍生物的创新抗癌药)二线治疗含铂化疗进展后的广泛期SCLC患者。该药可与DNA双螺旋结构上的小沟相结合,使得肿瘤细胞在有丝分裂过程中畸变而最终凋亡,进而减少细胞增殖。这项适应证获批是基于II期研究结果。
这项研究结果也在近期发表在《柳叶刀-肿瘤学》杂志上,在2015年10月至2018年10月纳入了105例经过一线铂类化疗的SCLC患者。结果显示,Lurbinectedin治疗的ORR为35.2%,疾病控制率(DCR)为68.6%,中位DoR为5.3个月,中位PFS为3.9个月,中位OS为9.3个月。
表1Lurbinectedin的II期研究结果

6
GemtuzumabOzogamicin获批用于CD33+AML儿童患者

6月16日,美国FDA批准靶向CD33的抗体偶联药物(ADC)——GemtuzumabOzogamicin用于治疗年龄≥1个月的新诊断患有CD33+AML的儿童患者。该适应证获批是基于AAML0531研究结果。
该随机临床试验纳入了1063例0-29岁之间的新诊断AML患者,入组后随机分为化疗组或GemtuzumabOzogamicin+化疗组。结果显示,相比单纯化疗组,GemtuzumabOzogamicin+化疗组成功带来无事件生存期(EFS)获益,;两组在5年内无诱导失败、复发或死亡的患者估计比例分别为48%vs40%。
7
又一不限癌种适应证获批,帕博利珠单抗后线治疗TMB-H实体瘤ORR达29%

6月16日,帕博利珠单抗获批用于单药后线治疗TMB-H的晚期实体瘤患者。TMB作为近年来新兴的免疫治疗标志物,可用于免疫药物的疗效,这项适应证获批也印证了TMB在肿瘤治疗中的应用价值。同一天,FDA还批准了FoundationOneCDx测定法作为使用帕博利珠单抗的一种伴随诊断。
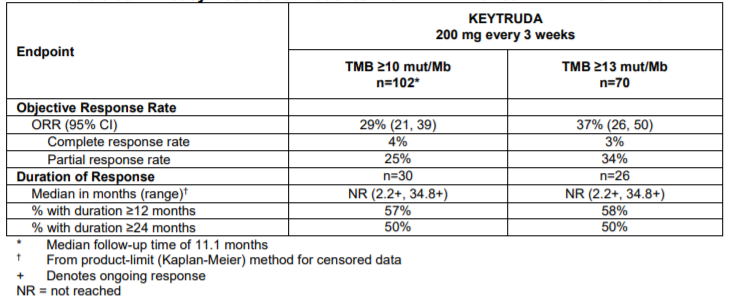
该批准是基于KEYNOTE-158II期研究。该研究纳入了1050例晚期实体瘤(包括肛门癌、胆道癌、宫颈癌、子宫内膜癌、唾液腺癌、甲状腺癌、外阴癌、间皮瘤、神经内分泌肿瘤或SCLC)患者,接受帕博利珠单抗单药治疗。在TMB-H患者中,ORR为30.3%,其中包括4%的完全缓解(CR)率;而非TMB-H患者的ORR仅为6.7%。TMB-H和非TMB-H患者的中位PFS均为2.1个月,12个月PFS率分别为24.3%和14.0%。
表2KEYNOTE-158研究的结果
8
Tazemetostat获批用于EZH2突变R/RFL,三线及以上ORR达69%

6月18日,FDA批准EZH2抑制剂Tazemetostat用于既往至少二线治疗失败的EZH2突变阳性R/RFL患者和没有其他令人满意的治疗选择R/RFL患者。同一天,FDA还批准了cobasEZH2突变测定法作为使用Tazemetostat的一种伴随诊断。
该适应证获批是基于E7438-G000-101研究结果。该试验入组了既往至少接受过2种系统性治疗的R/RFL患者。结果显示,Tazemetostat治疗42例EHZ2突变阳性FL患者的ORR为69%,其中包括12%的CR率。这些患者的中位DoR为10.9个月,相比之下,EHZ2阴性患者的ORR为34%。
表3E7438-G000-101研究的结果

9
Selinexor获批用于三线及以上治疗复发或难治性DLBCL

6月22日,XPO1靶点新药Selinexor获批用于既往至少二线治疗失败的复发或难治性非特指型弥漫性DLBCL患者,包括FL引起的DLCBL。该适应证获批是基于IIb期的SADAL研究结果。
该研究纳入了134例既往中位治疗线数为2的复发或难治性DLBCL患者。结果显示,Selinexor的ORR为29%,其中包括13%的CR。在DoR方面,56%患者持续≥3个月,38%患者≥6个月,15%患者≥12个月。作为全球靶向XPO1的口服药物,SADAL研究的数据突显了Selinexor在复发或难治性DLBCL患者中的治疗潜力,为这部分患者提供了有效的后线治疗方案。
表4SADAL研究的结果

10
帕博利珠单抗获批皮肤鳞癌,单药ORR达34%

6月24日,帕博利珠单抗获批用于无法通过手术或放疗治愈的复发或转移性cSCC。cSCC是继黑色素瘤之后第二常见的皮肤癌。这项适应证获批是基于KEYNOTE-629研究结果。
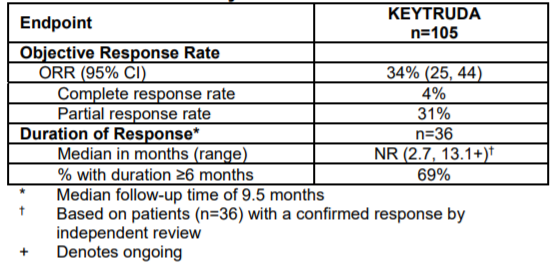
该研究共纳入105例cSCC患者,其中87%患者既往接受过一线及以上的治疗方案,74%患者接受过放疗。结果显示,总人群的ORR为34%,其中4%达到CR。中位DoR未达到,69%患者的DoR持续了≥6个月。
表5KEYNOTE-629研究的结果
参考资料
[1]
[2]
[3]
[4]
[5]MarabelleA,FakihM,LopezJ,;30(suppl_5)::10.1093/annonc/mdz253
[6]
[7]
本文首发:医学界肿瘤频道
责任编辑:Sharon
版权申明
本文原创如需转载请联系授权
--

song
送
fu
福
li
利
la
啦
关于,
你还想了解哪些?
说不定会被翻牌子哦~

留言+分享
轻轻松松get医学界周边好物~

CD30、MET、RET等靶向新药大波来袭!
五大癌种十大新适应证获批!全球喜迎靶向及免疫治疗新进展!
全球首个选择性MET抑制剂获批用于肺癌患者








