全面开花广谱抗癌,是很多抗癌新药的目标,只是这目标并不容易实现。最近几年免疫治疗的狂飙突进,的确让人耳目一新,但是极速前进的,又何止PD-1/L1抑制剂们呢?
在近期的欧洲肿瘤内科学会(ESMO)年会上,PARP抑制剂奥拉帕利(Olaparib)两项重要III期试验结果公布,治疗卵巢癌和前列腺癌双双告捷[1-2]!算上今年年中的胰腺癌治疗突破[3],“合成致死”领域的领头羊,可谓是喜讯三连发啊。
问题时间到:PARP抑制剂的中文名后缀都是啥?
合成致死、PARP抑制剂、BRCA1/2基因这些名词,奇点糕的老朋友们应该不会太陌生,不过温故而知新,复习一下也挺好的。简单地说,PARP抑制剂的抗癌机制,是利用癌细胞在DNA损伤修复方面的缺陷。
每时每刻,人体内的细胞都可能因为各种内源性或外源性的因素,出现DNA的损伤,每个细胞每天的损伤接近10万次[4]。但细胞真正因为损伤出现的基因突变,却远比这个数字要低,这得益于细胞内精密高效的DNA修复系统。
比如DNA单链断裂的修复,就有PARP-1/2酶参与,而更严重的双链断裂,则有非同源末端连接(NHEJ),和BRCA蛋白参与的同源重组(HR)修复。前者快速但不精密,可能导致细胞出大错,而后者慢速但精密。

这张图里,SSB和DSB就分别代表单链和双链断裂
细胞的癌变少不了基因突变,所以癌细胞的DNA修复系统,和正常细胞相比肯定有些问题。但为了维持自身的稳定,癌细胞也不能彻底抛弃DNA修复,往往是让它们部分停工,比如BRCA基因突变的癌细胞,同源重组修复就不灵了。
癌细胞这样做,其实是给自己埋雷。
举个例子,假如BRCA1/2发生突变,精密的双链修复就没了,如果PARP酶的单链修复路径再被堵死,就只剩下非同源末端连接修复了,这种修复越多,出现致命错误的可能性就越大,癌细胞迟早会因为DNA无法修复而毙命!
这就是PARP抑制剂抗癌的理论基础,它的原理被称为“合成致死”,即:某两个特定基因突变同时出现会致死,但单独发生突变时,不会造成致命伤害的现象,这里的两个基因,就分别指突变的BRCA基因,和被抑制剂切断的PARP通路[5]。
而奥拉帕利就是第一种正式上市的PARP抑制剂,它在2014年获批用于携带BRCA1/2突变卵巢癌患者的治疗,此后在卵巢癌上不断扩大适用范围,还在2018年进军到了乳腺癌领域。

奥拉帕利的成功,其实也稍稍走过一点儿弯路
本次ESMO年会上公布的奥拉帕利第一项成功试验,就来自PARP抑制剂的主战场——卵巢癌。目前PARP抑制剂的用法主要是维持治疗,也就是接续在铂类药物化疗后,用于延缓化疗后完全/部分缓解患者的病情进展。
除了延缓病情进展,维持治疗还有另外一层意义:推迟癌细胞产生化疗耐药性。卵巢癌的一大特点是容易复发,而复发就需要化疗等方法的再治疗,这样下去癌细胞就可能出现耐药。一旦铂类药物化疗耐药,患者的治疗选择就会严重受限。
所以,维持治疗在卵巢癌上的地位非常重要,而PARP抑制剂的表现最抢眼。拿奥拉帕利来说,它用到携带BRCA1/2突变,且接受过两轮化疗的患者时,能将无进展生存期(PFS)从5.5个月延长到19.1个月,疾病进展风险相对降低了70%[6]!
PARP抑制剂不仅疗效好,使用范围也在不断扩大,比如奥拉帕利用到患者第一轮化疗之后,作为一线的维持治疗,同样取得了风险相对下降70%的成绩[7],或者是用到接受过三轮、四轮甚至更多轮化疗后的患者当中。

这种维持治疗的效果,让很多专家认为卵巢癌已经快变成慢性病了
而这次公布的PAOLA-1试验同样是一线维持治疗,但却有两大不同之处:第一是治疗方案,对照组的维持治疗用药是贝伐珠单抗,奥拉帕利组则是与贝伐珠单抗联合治疗;第二是入组患者群体扩大,不局限于携带BRCA1/2突变的患者。
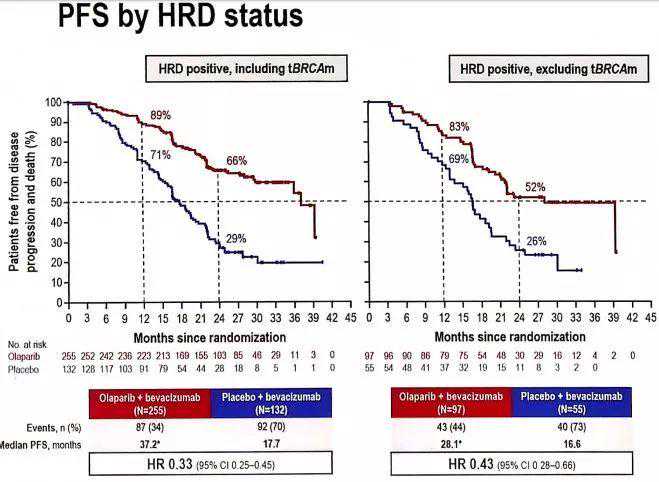
试验结果显示,对PAOLA-1试验入组的全部806名患者(2:1分组),奥拉帕利+贝伐珠单抗联合治疗组的PFS达到22.1个月,超过贝伐珠单抗单药组的16.6个月,患者疾病进展的风险相对下降了41%!

从亚组分析来看,奥拉帕利+贝伐珠单抗联合治疗的获益,主要来自存在同源重组缺陷(HRD)基因突变的患者,比如治疗存在BRCA1/2突变的患者时,两种治疗方案的PFS是37.2个月对21.7个月,患者的疾病进展和死亡风险下降了69%。
对不携带BRCA1/2突变,但存在其他HRD基因突变的患者,联合治疗也效果较好,患者PFS从16.6个月延长到28.1个月,疾病进展的风险相对下降了57%。然而用到不存在HRD突变的患者身上,联合治疗的收益就不大了。
所以联合治疗方案最终怎么用,还有待权威认定
试验中联合治疗的安全性,整体也与贝伐珠单抗单药差异不大。PAOLA-1的成功,再加上此前SOLO-1/2/3这一系列试验的良好表现,让奥拉帕利向卵巢癌维持治疗的全病程覆盖更进一步,接近实现“游戏通关”了。
而奥拉帕利的第二项成功,得先从试验的患者群体说起——转移性去势抵抗性前列腺癌(mCRPC)。这么长的名字真让人晕,但仔细一看,转移性和前列腺癌都好理解,重点就在“去势抵抗性”上面。
这里的去势,是指前列腺癌治疗中的雄激素剥夺治疗(ADT)。前列腺癌细胞对雄激素很依赖,所以ADT的初步疗效一般不错,但癌细胞迟早会产生对传统ADT疗法的抵抗性,也就是“去势抵抗性”。
发展出抵抗,身经百战的癌细胞,凶残程度肯定更高,再加上转移性,治疗难度就不用多说了吧?一旦到了转移阶段,不管是新型内分泌治疗、化疗还是免疫治疗,疗效目前都不够让人满意。

前列腺癌防治的“蓝丝带”,很多人真不一定听过吧?
其实最近几年,mCRPC患者的5年生存率,已经从10%提升到了接近30%[8],但相比早期患者5年生存率超过90%的数字,差距就很大了。尤其是经过新型内分泌治疗后的患者,目前的治疗还缺乏可靠证据支持的有效方案。
治疗需要新方向,而基因组层面的分析显示,存在BRCA1/2、ATM等同源重组修复(HRR)相关基因突变,以及其它DNA损伤修复通路基因突变的患者,在mCRPC中占到近1/4[9]。这些患者,理论上不就是PARP抑制剂的适用群体吗?
2015年公布的II期试验数据显示,治疗存在DNA损伤修复通路基因突变的mCRPC患者时,奥拉帕利的复合响应率(包括影像学肿瘤缓解、前列腺特异性抗原降低至少50%、血液中循环癌细胞数降至5个/7.5ml以下)高达88%[10],这么好的数据,开展III期试验可以说是顺理成章。
本次公布的III期试验PROfound,入组了387名携带HRR相关基因突变,且在醋酸阿比特龙或恩杂鲁胺治疗后,病情进展的mCRPC患者,按2:1分组分别使用奥拉帕利和新型内分泌治疗(醋酸阿比特龙或恩杂鲁胺,医生选择)。
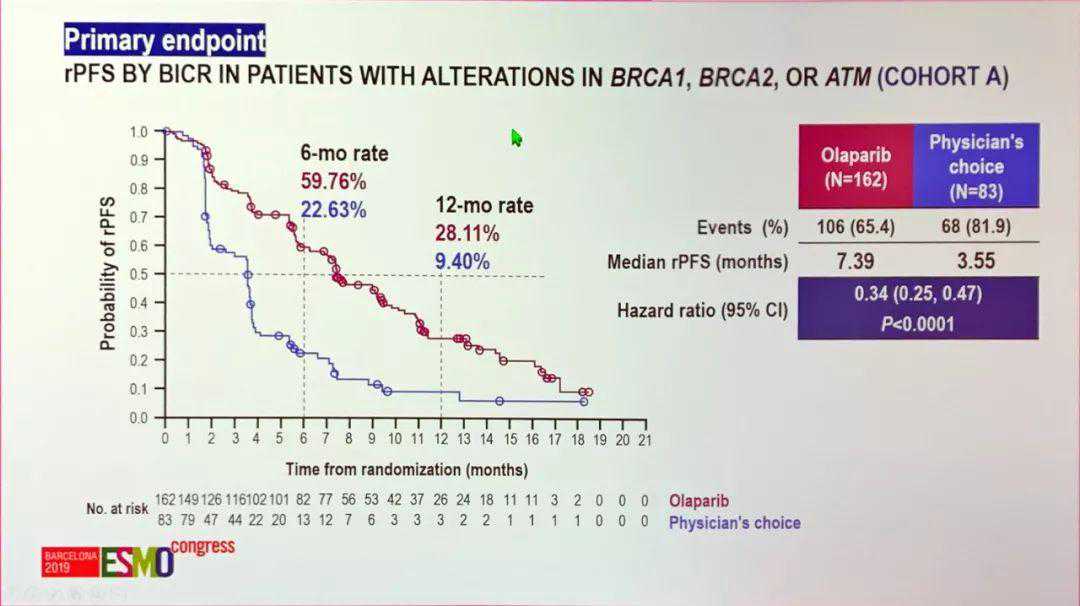
试验还对患者做了进一步的细分,经检测携带BRCA1/2、ATM突变的245名患者被分到队列A,另外12个HRR相关基因突变的142名患者是队列B,而试验的主要终点——影像学检查评价的无进展生存期(rPFS),看的就是队列A的数据。
奥拉帕利交出了怎样的答卷呢?从数据上看,奥拉帕利的rPFS达到7.39个月,显著优于对照组的3.55个月!而在如客观缓解率(33.3%对2.3%)、总体生存期(18.5个月对15.1个月)等次要终点上,奥拉帕利也整体优于对照组。
从这届ESMO年会能看出,PARP抑制剂的确是炙手可热——年会主会场公布的14项试验结果中,有6项来自PARP抑制剂,比例甚至超过了免疫治疗!
奥拉帕利作为领头羊,当然也不例外,这次两项试验的成功,加上之前胰腺癌的突破,让它很有希望在卵巢癌和乳腺癌之后,开辟全新的适应症。其他癌种上的试验,更是让“合成致死”的全面开花,指日可待啦。
参考资料:
1.Ray-CoquardIL,PautierP,PignataS,/ENGOT-ov25trial:Olaparibplusbevacizumab(bev)asmaintenancetherapyinpatients(pts)withnewlydiagnosed,advancedovariancancer(OC)treatedwithplatinum-basedchemotherapy(PCh):ESMOCongress2019,Barcelona,Spain,September27toOctober1,2019.LBA2_PR.
2.,:PhaseIIIstudyofolaparibversusenzalutamideorabirateroneformetastaticcastration-resistantprostatecancer(mCRPC)withhomologousrecombinationrepair(HRR):ESMOCongress2019,Barcelona,Spain,September27toOctober1,2019.LBA12_PR.
3.GolanT,HammelP,ReniM,ancer[J].TheNewEnglandJournalofMedicine,2019.
4.,Aging,andCancer[J].TheNewEnglandJournalofMedicine,2009,361(15):1475-1485.
5.PiliéPG,TangC,MillsGB,cer[J].NatureReviewsClinicalOncology,2019,16(2):81-104.
6.Pujade-LauraineE,LedermannJA,SelleF,tive,relapsedovariancancerandaBRCA1/2mutation(SOLO2/ENGOT-Ov21):adouble-blind,randomised,placebo-controlled,phase3trial[J].TheLancetOncology,2017,18(9):1274-1284.
7.MooreKN,ColomboN,ScambiaG,ancer[J].TheNewEnglandJournalofMedicine,2018,379(26):2495-2505.
8.FranciniE,GrayKP,ShawG,(OS)ofpatients(pts)withmetastaticcastrationresistantprostatecancer(mCRPC)inahospital-basedregistry[J].JournalofClinicalOncology,2018,36(6_suppl):203.
9.RobinsonD,VanAllenEM,WuYM,[J].Cell,2015,161(5):1215-1228.
10.MateoJ,CarreiraS,SandhuS,[J].NewEnglandJournalofMedicine,2015,373(18):1697-1708.
本文作者|谭硕